

Получение Регистрационного удостоверения (далее РУ) на медицинские изделия в Федеральной службе по надзору в сфере здравоохранения и социального развития (Росздравнадзор) является первым необходимым условием, чтобы осуществлять производство, продажу и применение медицинских изделий на территории Российской федерации. РУ подтверждает качество, эффективность и безопасность использования медицинских изделий (на основании результатов проведенных испытаний и соответствующих оценок).
Действие РУ не имеет срока при условии, если указанные в нем сведения о медицинском изделии, его изготовителе и о лице, на имя которого изделие медицинского назначения зарегистрировано, остаются неизменными.
Стоимость медицинского изделия формируется в соответствии с характеристиками медицинского изделия. Определяющими моментами в формировании цены являются: класс потенциального риска, функциональные характеристики и конструкционные особенности (количество составных частей). На основании этих параметров определяется порядок проведения испытаний и регистрационной процедуры. Поэтому стоимость и сроки регистрации Вы можете узнать, направив нам заявку.
Процедура рассмотрения документов и принятия решения о регистрации медицинского изделия в Росздравнадзоре проводится в срок до 4 месяцев с момента подачи пакета документов. Процесс рассмотрения документов и принятия решения о регистрации может быть сокращен до 2 месяцев в случае, если медицинское изделие относится к 1 или 2а классу и имеет зарегистрированный на территории Российской Федерации аналог.
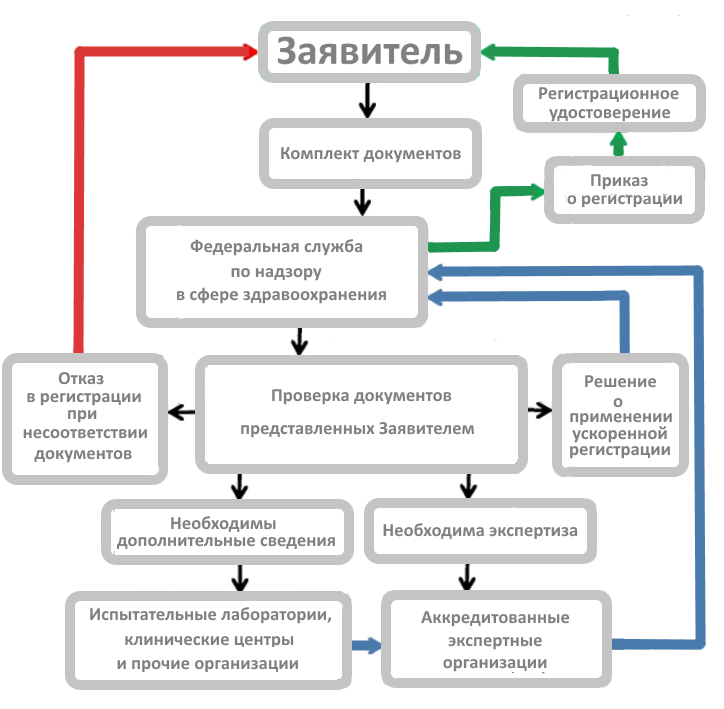
Поэтому длительность процедуры регистрации можно определить периодом от 2 до 4 месяцев, согласно регламенту (не считая времени проведения технических испытаний).